| Scan | Original |
|---|---|
| 11 | |
| 12 | |
| 13 | |
| 14 | |
| 15 | |
| 16 | |
| 17 |
- Text
- Text Image
- Image
- XML
- Thumbnail overview
- Document information
Die mittlere lebendige Kraft aller Momentoiden eines
Systems ist also dieselbe und

wobei L die lebendige Kraft des Systems bedeutet.
§ 7. Ideale Gase. Absolute Temperatur.
Die entwickelte Theorie enthält als speciellen Fall die
Maxwell’sche Zustandsverteilung der idealen Gase. Verstehen
wir nämlich in § 3 unter dem System S ein Gasmolecül, unter  die Gesamtheit aller anderen, so folgt für die Wahrschein-
die Gesamtheit aller anderen, so folgt für die Wahrschein-
lichkeit, dass die Werte der Variabeln p1...qn von S in
einem in Bezug auf alle Variabeln unendlich kleinen Gebiet g
liegen, der
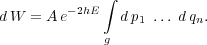
Auch erkennt man sogleich aus unserem, für die Grösse h in
§ 3 gefundenen Ausdruck, dass die Grösse h bis auf unend-
lich Kleines die nämliche wäre für ein Gasmolecül anderer
Art, welches in dem Systeme vorkommt, in dem die Systeme  ,
,
welche h bestimmen, für beide Molecüle bis auf unendlich
Kleines identisch sind. Damit ist die verallgemeinerte Max-
well’sche Zustandsverteilung für ideale Gase erwiesen.
Ferner folgt sofort, dass die mittlere lebendige Kraft der
Schwerpunktsbewegung eines Gasmolecüles, welches in einem
System S vorkommt, den Wert 3/4 h
besitzt, weil dieselbe drei
Momentoiden entspricht. Nun lehrt die kinetische Gastheorie,
dass diese Grösse proportional dem vom Gase bei constanten
Volumen ausgeübten Druck ist. Setzt man diesen definitions-
gemäss der absoluten Temperatur T proportional, so hat man
eine Beziehung von der
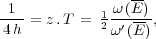
wobei z eine universelle Constante, 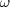 die in § 3 eingeführte
die in § 3 eingeführte
Function