List of thumbnails
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
für die auf das Grammäquivalent bezogene spezifische Wärme
des Stoffes
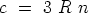
oder -- in Grammkalorien ausgedrückt --
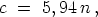
wenn n die Anzahl der Atome im Molekül bedeutet. Es ist
bekannt, daß diese Beziehung für die meisten Elemente und
für viele Verbindungen im festen Aggregatzustand mit be-
merkenswerter Annäherung erfüllt ist (Doulong-Petitsches
Gesetz, Regel von F. Neumann und
Betrachtet man jedoch die Tatsachen etwas genauer, so
begegnet man zwei Schwierigkeiten, die der Anwendbarkeit
der Molekulartheorie enge Grenzen zu ziehen
1. Es gibt Elemente (Kohlenstoff, Bor und Silizium),
welche im festen Zustande bei gewohnlicher Temperatur eine
bedeutend kleinere spezifische Atomwärme besitzen als 5,94.
Es haben ferner alle festen Verbindungen, in denen Sauerstoff,
Wasserstoff oder mindestens eines der eben genannten Ele-
mente vorkommen, eine kleinere spezifische Wärme pro Gramm-
molekül n. 5, 94.
2. Hr. Drude hat gezeigt1), daß die optischen Erschei-
nungen (Dispersion) dazu führen, jedem Atom einer Verbindung
mehrere unabhängig voneinander bewegliche Elementarmassen
zuzuschreiben, indem er mit Erfolg die ultraroten Eigen-
frequenzen auf Schwingungen der Atome (Atomionen), die
ultravioletten Eigenfrequenzen auf Schwingungen von Elek-
tronen zurückführte. Hieraus ergibt sich für die molekular-
kinetische Theorie der Wärme eine zweite bedeutende Schwierig-
keit, indem die spezifische Wärme -- da die Zahl der beweg-
lichen Massenpunkte pro Molekül größer ist als dessen Atom-
zahl -- den Wert 5, 94 n
beträchtlich übersteigen
Nach dem Obigen ist hierzu folgendes zu bemerken. Wenn
wir die Träger der Wärme in festen Körpern als periodisch
schwingende Gebilde ansehen, deren Frequenz von ihrer
Schwingungsenergie unabhängig ist, dürfen wir nach der
Planckschen Theorie der Strahlung nicht erwarten, daß die
1) P. Drude, Ann. d. Phys. 14. p. 677. 1904.